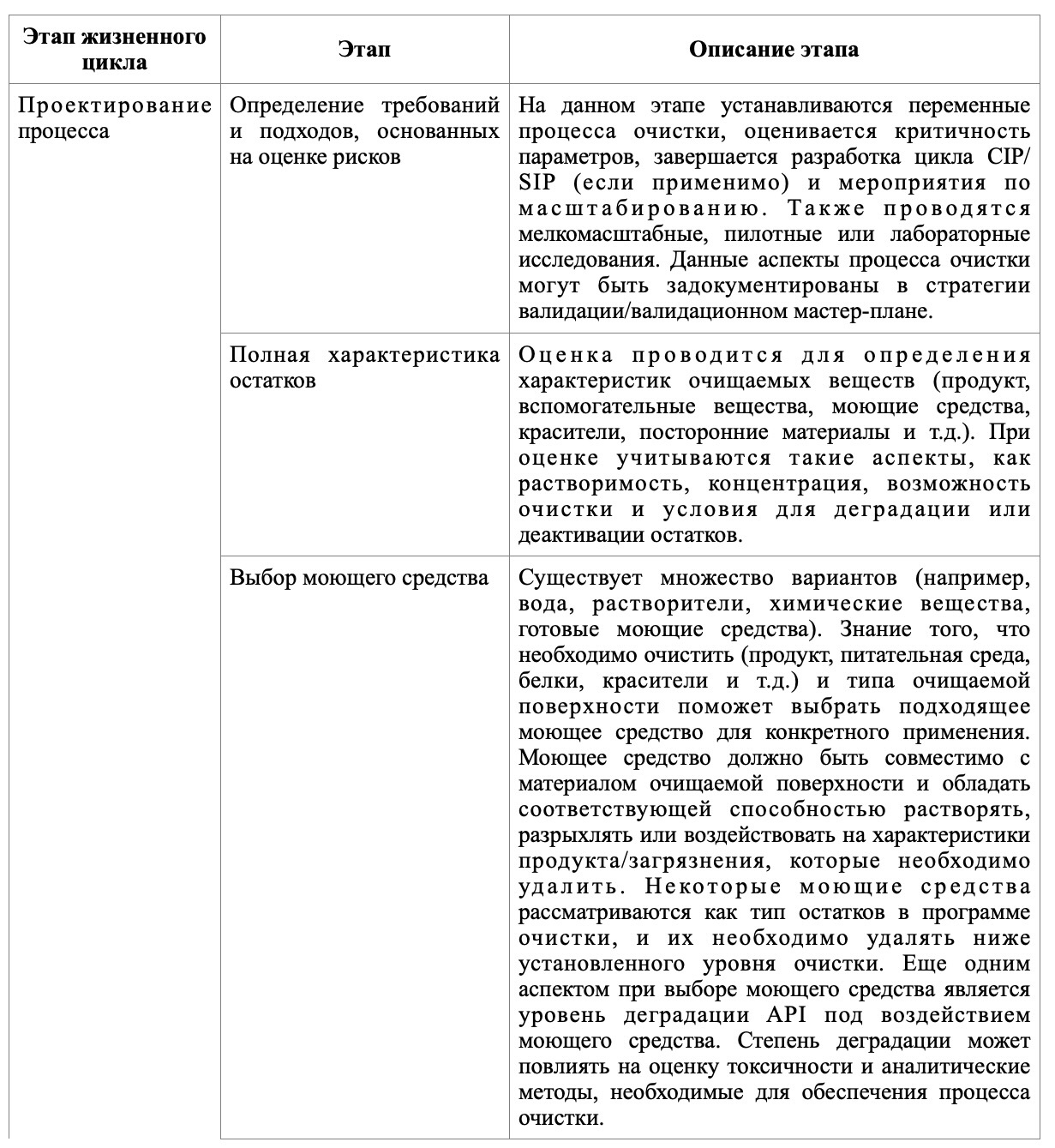
Очистка считается критически важным процессом при производстве фармацевтической продукции. Традиционная программа валидации очистки делает акцент на демонстрации того, что метод очистки работает так, как запланировано, посредством программы валидации. Однако, современная практика признает, что более эффективным подходом является рассмотрение валидации очистки как жизненного цикла, где акцент смещается с выполнения квалификации очистки на разработку программы очистки и постоянную проверку очистки в процессе использования того или иного метода очистки.
Жизненный цикл валидации очистки опирается на принципы качества через дизайн (Quality by Design), согласно которым качество не может быть оценено только путем тестирования. Поэтому необходимо разработать процессы, определить критические параметры и контролировать процесс очистки для проверки текущей эффективности и обеспечения надлежащего результата. Надлежащий результат, ожидаемый от процесса очистки, - это достижение последовательной очистки поверхностей, имеющих прямой контакт с продуктом, до заданного уровня чистоты, который не представляет вреда для пациентов и не влияет на качество продукта (безопасность, подлинность, активность).
Подход к валидации процесса очистки на основе жизненного цикла является более комплексным, чем традиционный подход, поскольку использование подхода жизненного цикла гарантирует, что процесс очистки непрерывно остается в контролируемом состоянии и обеспечивает получение знаний для совершенствования процесса.
Внедрение подхода, основанного на жизненном цикле, может быть сложным для существующих продуктов, где этап разработки процесса очистки может быть не полностью документирован.
Внедрение подхода, основанного на жизненном цикле, может быть сложным для существующих продуктов, где этап разработки процесса очистки может быть не полностью документирован.
Традиционный подход FDA к валидации процессов включает три стадии:
- Стадия 1: проектирование процесса (Cleaning Process Design) - процесс очистки определяется на основе знаний, полученных в ходе разработки и масштабирования.
- Стадия 2: квалификация процесса (Cleaning Process Performance Qualification (Cleaning PPQ)) - процесс очистки выполняется для демонстрации того, что разработанный и спроектированный процесс дает ожидаемые результаты воспроизводимым образом.
- Стадия 3: непрерывная верификация процесса (Continued Cleaning Process Verification) - обеспечивает контроль критических переменных процесса очистки, мониторинг критических переменных процесса очистки и контроль над процессом.
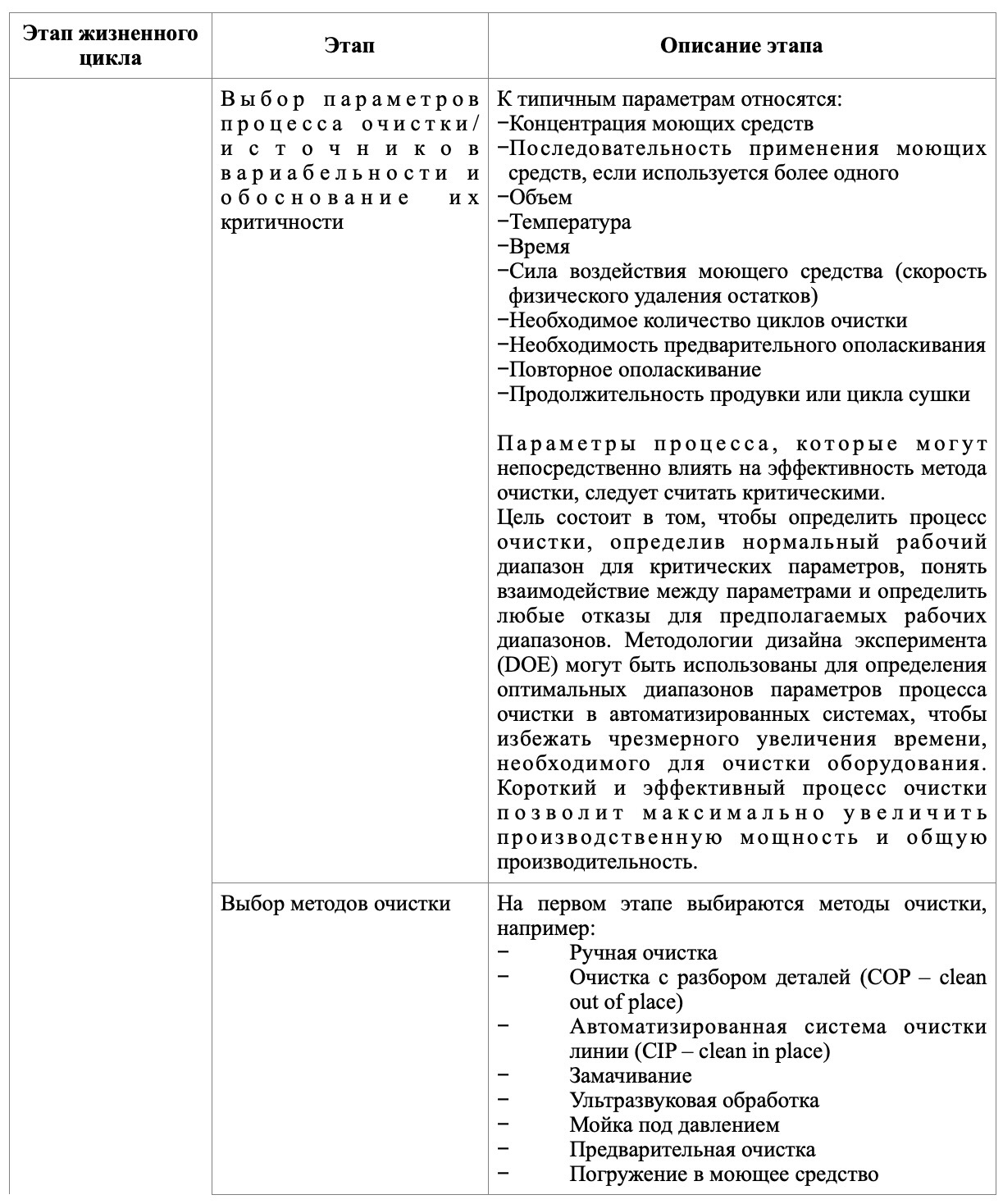
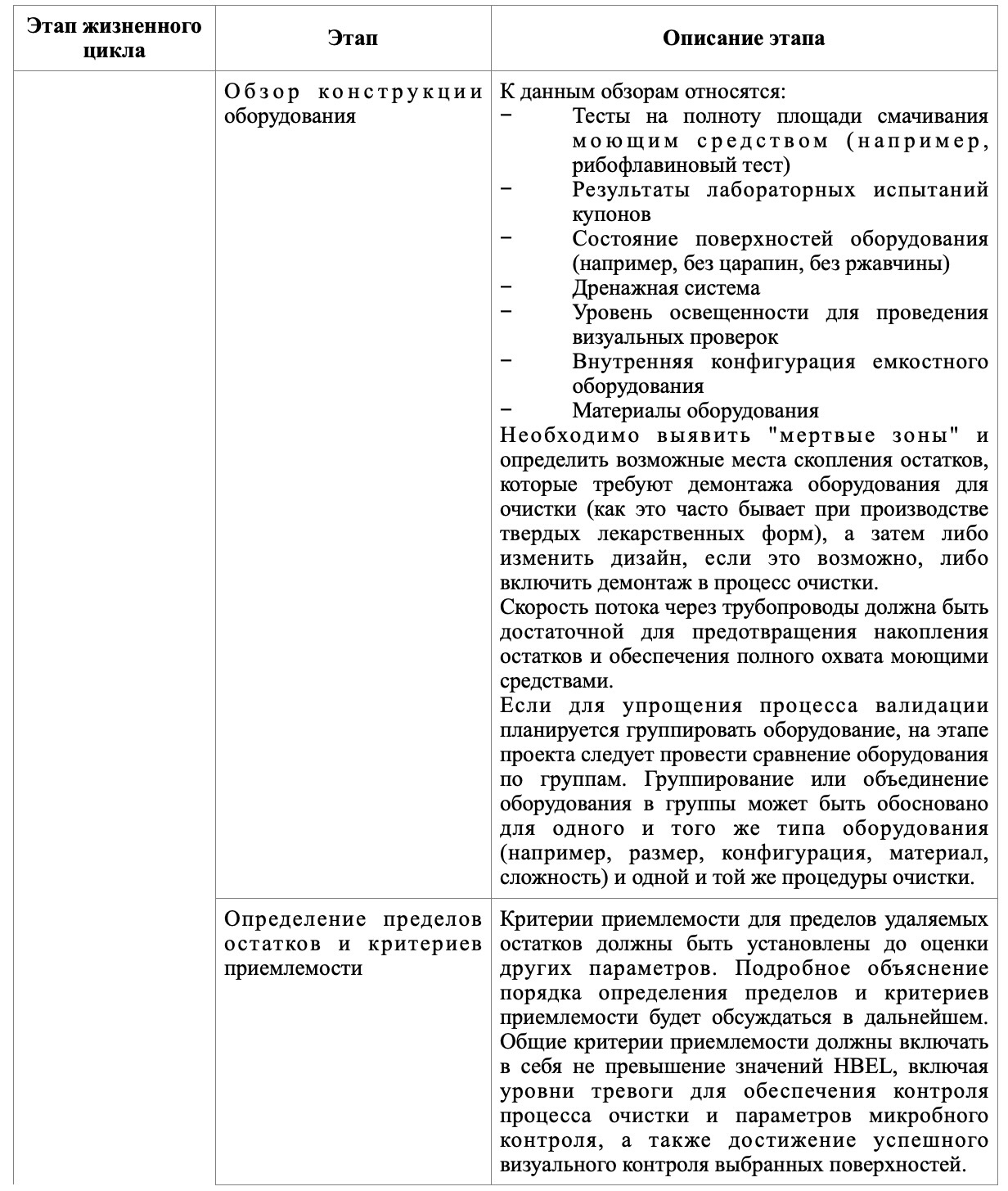
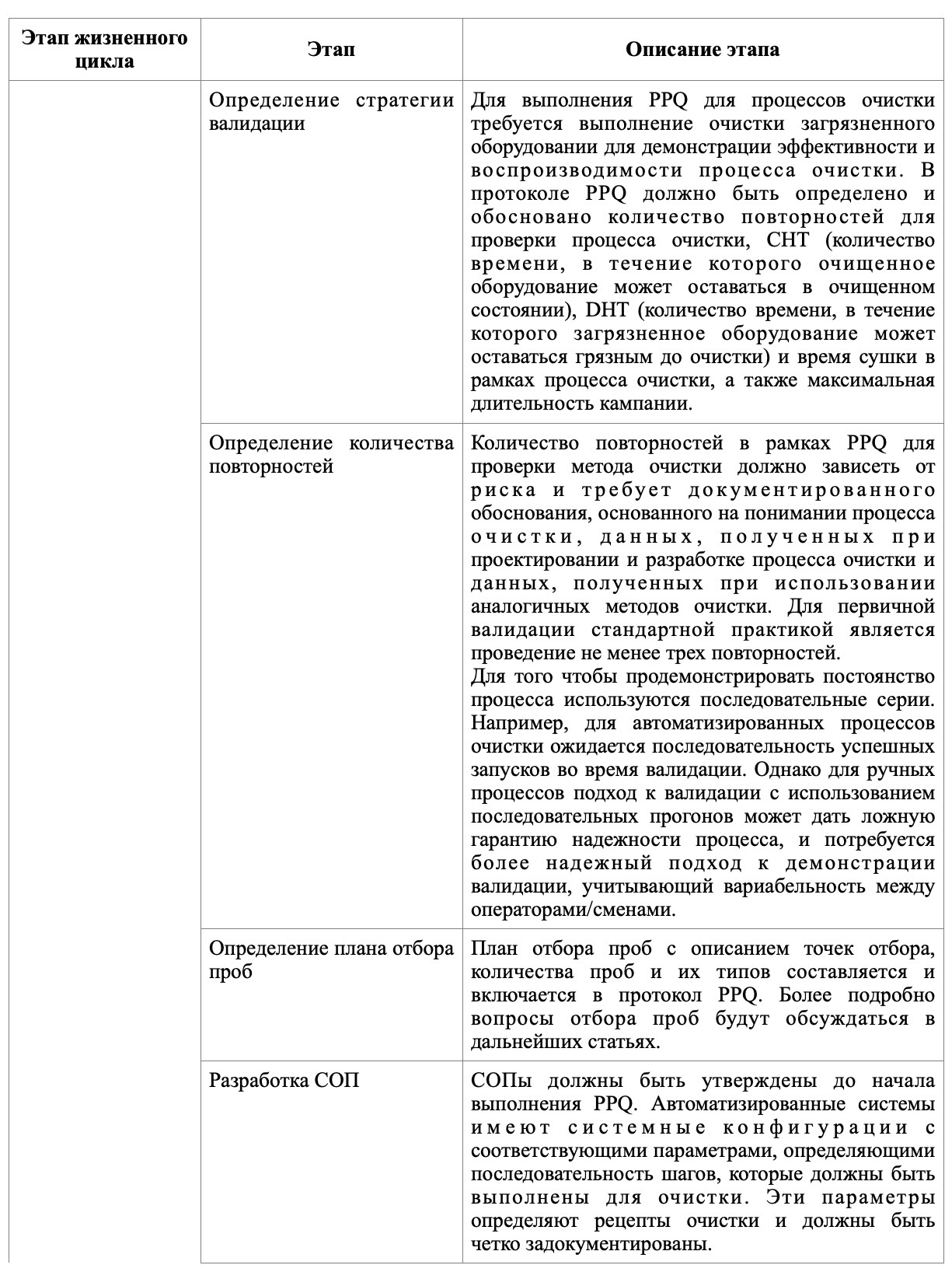
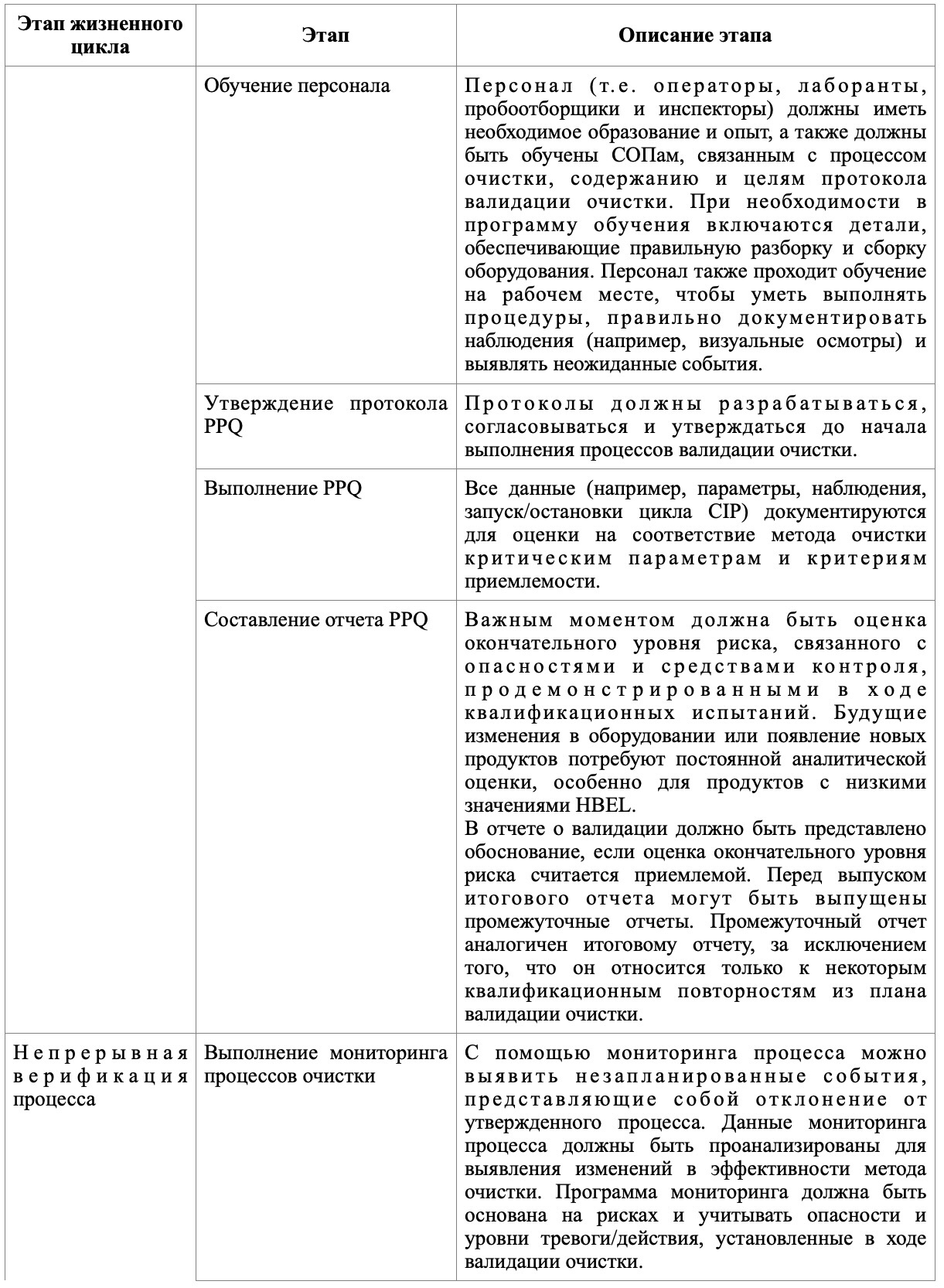
В таблице представлены основные этапы, которые следует отразить на каждом из этапов валидации очистки.

Решение о повторной валидации процесса очистки обычно принимается в контексте изменений, внесенных в систему. Значительные изменения, влияющие на параметры очистки, аналитические методики, новые технологии или возможности выполнения процесса, могут потребовать проведения повторной валидации. Однако не все причины для повторной валидации возникают из-за отдельных изменений, управляемых через систему контроля изменений. Процесс периодического обзора позволяет комплексно оценить все элементы, используемые для управления процессом очистки в течение длительного периода времени (обычно лет), и определить, продолжает ли он работать в подтвержденном состоянии или имеются отклонения от ожидаемых показателей. Объем ревалидации может быть ограничен определенными аспектами процесса очистки (например, проверкой времени выдержки при очистке) на основе результатов оценки, проведенной в ходе периодического обзора.
