Целью микробиологического мониторинга является оценка чистоты производственной среды (стерильное и нестерильное производство). Микробиологический мониторинг производственной среды включает в себя сбор данных, касающихся количества случаев присутствия микроорганизмов на поверхностях, в воздухе и на персонале.
Целями программы микробиологического мониторинга производственной среды являются:
Производственная среда чистых помещений
Производственная среда, в которой осуществляется процесс, либо классифицируется (в соответствии со стандартом чистых помещений ISO 14644), либо контролируется (CNC). Чистые помещения и чистые зоны обычно классифицируются в зависимости от их использования (основной вид деятельности в каждом помещении или зоне), контролируются с помощью работы систем отопления, вентиляции и кондиционирования воздуха (HVAC), при этом классификация подтверждается чистотой воздуха путем измерения содержания частиц. Кроме того, рекомендуемые пределы применяются для микроорганизмов.
Основными источниками загрязнения являются персонал и вода. Это связано с тем, что эти источники являются переносчиками загрязнения. Персонал является наиболее значительным источником загрязнения, очень изменчивым и непредсказуемым. Микроорганизмы попадают на волосы, кожу, глаза и слизистые оболочки. Вода часто используется в фармацевтической промышленности (в качестве ингредиента, моющего средства, разбавителя для дезинфицирующих средств, источника пара и т. д.). Проблема с водой в чистых помещениях заключается в том, что она не только обеспечивает микроорганизмам возможность выживания, но и дает возможность для увеличения их количества, а микроорганизмы неизменно присутствуют во всех остатках воды (некоторые бактерии, особенно грамотрицательные, могут расти и размножаться в условиях низкого содержания питательных веществ).
Вторичными источниками загрязнения являются воздух и поверхности. Воздух в большинстве помещений содержит микроорганизмы. Количество микроорганизмов зависит от класса чистоты помещения. Воздух является вторичным источником загрязнения, поскольку он является переносчиком микроорганизмов, но не является питательной средой, и, хотя некоторые бактерии могут выживать в потоках воздуха, они не могут в нем размножаться. Как правило, в воздухе чаще всего встречаются грамположительные бактерии. Микроорганизмы в воздухе обычно находятся вместе с частицами пыли или чешуйками кожи, а не в виде отдельных микроорганизмов (для обозначения которых иногда используется термин "частица, переносящая микроорганизмы"). Это делает микроорганизмы более тяжелыми и подверженными гравитационному оседанию. Поэтому зачастую важнее всего не количество микроорганизмов в воздухе, а их способность к оседанию. Хорошо спроектированное чистое помещение будет фильтровать воздух (чтобы уменьшить количество микроорганизмов) и иметь каскад давления, чтобы предотвратить повторное загрязнение чистой зоны из менее чистой (поскольку микроорганизмы не могут двигаться против воздушного потока).
Другим вторичным источником загрязнения являются материалы и поверхности. Здесь основными рисками являются перенос предметов в чистую зону и из нее, при этом материалы подвергаются большему риску, если они имеют конструкцию, которую невозможно легко очистить или продезинфицировать; а также в случае прикосновения персонала к поверхностям. Еще один риск - загрязнение поверхностей в результате осаждения (например, оседания из воздуха).
Как минимум, программа микробиологического мониторинга производственной среды должна включать следующие элементы:
Методы микробиологического мониторинга:
Аспирационный отбор проб воздуха
Активный пробоотборник воздуха (аспиратор) собирает определенную долю микроорганизмов, присутствующих в данном объеме воздуха. Объем отбираемого воздуха обычно составляет один кубический метр (результаты выражаются в КОЕ / м3).
В процессе эксплуатации аспираторов следует учитывать, что сами устройства могут генерировать относительно высокий уровень аэрозольных частиц, и это особенно должно учитываться при использовании в зонах класса A. К другим аспектам использования относится пригодность пробоотборника к дезинфицирующим средствам, используемым для оборудования чистых помещений.
Седиментационные пластины
Седиментационные пластины – это агаровые пластины, обычно диаметром 9 см или 14 см (чашки Петри). Они предназначены для обнаружения любых микроорганизмов, переносимых воздушным потоком, которые непосредственно оседают в определенной области. Если седиментационные пластины расположены в соответствующих местах, они могут дать представление о том, как часто и, возможно, как много микроорганизмов попало на критически важную поверхность или в любой подвергающийся воздействию продукт. Результаты, полученные с помощью седиментационных пластин, могут быть оценены как количество колоний микроорганизмов на пластину или полуколичественно путем подсчета количества микроорганизмов в единицу времени (время – это продолжительность контакта с пластиной). В таких руководствах, как EU GMP, уровни действий выражаются в КОЕ (колониеобразующих единицах) за четыре часа.
Для того чтобы определить, влияет ли потеря веса агара в пластине на ростовые свойства пластины после экспозиции, необходимо валидировать длительность использования пластины. Это можно оценить, разработав эксперимент, в котором пластины предварительно взвешиваются и выставляются на определенное время в наихудших условиях (обычно в шкафу с однонаправленным потоком воздуха (UDAF), поскольку такая среда вызывает наибольшее высыхание). После экспозиции пластины могут быть обработаны соответствующим набором тест-штаммов микроорганизмов, чтобы определить, повлияла ли степень "высыхания" на способность пластин поддерживать рост микроорганизмов.
Отбор образцов с поверхности: контактные пластины и свабы
Контактные пластины – это пластины агара, обычно диаметром 25 см2, с приподнятой (куполообразной) поверхностью, сконструированной таким образом, чтобы при переворачивании пластины агар прижимался к поверхности. Воспроизводимость контактных пластин можно повысить, установив время взятия пробы и контролируя прилагаемое давление. Для этого существуют коммерческие устройства.
Свабы обычно состоят из стерильных хлопковых (или чаще всего из синтетических) наконечников. Они либо содержатся в среде, либо требуют предварительного смачивания подходящей средой для восстановления (например, фосфатно-буферным солевым раствором или стерильной водой). Свабы либо предназначены для субкультивирования на агаре, либо растворяются и фильтруются через мембрану. Свабы удобны для отбора проб с небольших участков или изогнутых поверхностей.
Выделение микроорганизмов из контактных пластин превосходит таковое из свабов, поэтому предпочтительно использовать контактные пластины (при этом свабы могут использоваться там, где контактные пластины невозможны, например, на узких или неровных поверхностях).
Существует ряд практических соображений при отборе проб с поверхности. Важно, чтобы после использования контактных пластин или тампонов остатки (агар или растворитель) всегда протирались подходящим дезинфицирующим средством во избежании образования остаточного материала для роста микроорганизмов. Еще одним соображением является то, что при мониторинге критических видов деятельности отбор проб проводится по окончании деятельности из-за инвазивного характера отбора проб.
Мониторинг поверхностей также подразделяется на мониторинг поверхностей пола и стен и поверхностей оборудования на рабочей высоте. Поверхности оборудования на рабочей высоте обычно имеют более жесткие критерии и считаются более критичными, поскольку они являются зонами, контактирующими с продуктом. Пробы с пола/стен обычно имеют более низкие пределы, так как продукт не соприкасается с полом/стенами, и мониторинг этих мест служит проверкой методов очистки и дезинфекции.
Мониторинг персонала
Для некоторых операций, прежде всего асептических процессов, у персонала, работающего в чистых помещениях, отбираются образцы. Эти образцы представляют собой отпечатки перчаток, образцы с технологической одежды операторов (рукава часто являются зоной наибольшего риска в отношении манипуляций персонала с продуктом или оборудованием).
Пробы с перчаток отбираются с помощью пальцевых пластин, когда каждый палец руки в перчатке прижимается к поверхности агаровой пластины (размером 9 см или больше). Пробы рукавов отбираются с помощью контактных пластин. Таким образом, оба типа проб могут быть количественно определены как КОЕ на пять пальцев руки или как КОЕ на 25 см2. Кроме того, пробы перчаток и рукавов изоляторов и RABS (Rapid Access Barrier Systems) также берутся в конце кампаний (хотя эти пробы не избавляют от необходимости проверки герметичности перчаток и рукавов на месте). Пробы с рук персонала отбираются через различные промежутки времени после каждой критической операции. Для обеспечения репрезентативности результатов мониторинга руки операторов не должны быть обработаны перед отбором проб. Однако после отбора проб руки должны быть продезинфицированы с помощью дезинфицирующего средства. Пробы с технологической одежды отбираются по окончании процесса.
Выбор точек отбора проб
Порядок выбора точек отбора проб описан в первой статье «Мониторинг производственной среды».
Обязанности по отбору проб
Сотрудники, отбирающие пробы для мониторинга, должны быть четко определены в письменной процедуре. Обычно пробы отбирают обученные микробиологи в асептических зонах, однако существуют два различных подхода. Согласно одному подходу, все пробы для мониторинга производственной среды должны отбираться независимыми сотрудниками отдела контроля качества. Другой подход заключается в том, что присутствие дополнительного персонала в чистом помещении повышает риск, и чтобы избежать этого риска, мониторинг должен проводить производственный персонал. Альтернативный подход заключается в том, что производственный персонал должен отбирать большинство проб в асептической зоне, но при этом сотрудники отдела контроля качества должны периодически контролировать критический производственный процесс (например, отбирать пробы из расчета 1 к 10). Если пробы отбирает производственный персонал, важно, чтобы он проходил такую же строгую программу обучения, как и сотрудники отдела контроля качества, и был обучен основам микробиологии.
Периодичность мониторинга
Периодичность мониторинга производственной среды для стерильных продуктов (асептически наполненных или термически стерилизованных) определена в нормативном руководстве: он должен быть непрерывным в течение всего процесса наполнения и в те моменты, когда продукт или его компоненты подвергаются воздействию. Мониторинг производственной среды для других видов деятельности требует установки частоты мониторинга, основанной на оценке риска деятельности в чистом помещении. Периодичность мониторинга должна быть достаточно частой, чтобы можно было оценить значимые тенденции. К числу рисков, которые необходимо учитывать, относятся:
После детальной оценки этих факторов устанавливается периодичность мониторинга: помещения, в которых происходит открытая обработка или в которых работает большое количество персонала, требуют более частого мониторинга, в то время как помещения, в которых происходит автоматизированная обработка или которые используются редко, требуют более низкого уровня мониторинга. Для нестерильного производства подходящей периодичностью мониторинга являются два раза в неделю, один раз в неделю, каждые две недели и ежемесячно.
Целями программы микробиологического мониторинга производственной среды являются:
- Мониторинг чистых помещений, сбор данных и изучение тенденций, чтобы показать состояние микробиологического контроля производственной среды. Мониторинг имеет большее значение, если среда оценивается в репрезентативных условиях (как правило, когда чистые помещения находятся в эксплуатируемом состоянии)
- Сбор данных может относиться либо к количеству микроорганизмов, либо к частоте их обнаружения, либо к обоим показателям (с использованием заранее установленных пределов мониторинга). Кроме того, некоторые из выделенных микроорганизмов должны быть охарактеризованы и прослежены в динамике
- Оценка рисков для производственной среды и, самое главное, для продукта. Это достигается путем выбора репрезентативных точек мониторинга, а также путем проведения мониторинга с частотой, позволяющей выявить тенденции
- Оценка эффективности программы очистки
- Понимание эффективности работы персонала и оборудования
- Предоставление информации об уровне контроля производственной среды (например, работы системы HVAC)
Производственная среда чистых помещений
Производственная среда, в которой осуществляется процесс, либо классифицируется (в соответствии со стандартом чистых помещений ISO 14644), либо контролируется (CNC). Чистые помещения и чистые зоны обычно классифицируются в зависимости от их использования (основной вид деятельности в каждом помещении или зоне), контролируются с помощью работы систем отопления, вентиляции и кондиционирования воздуха (HVAC), при этом классификация подтверждается чистотой воздуха путем измерения содержания частиц. Кроме того, рекомендуемые пределы применяются для микроорганизмов.
Основными источниками загрязнения являются персонал и вода. Это связано с тем, что эти источники являются переносчиками загрязнения. Персонал является наиболее значительным источником загрязнения, очень изменчивым и непредсказуемым. Микроорганизмы попадают на волосы, кожу, глаза и слизистые оболочки. Вода часто используется в фармацевтической промышленности (в качестве ингредиента, моющего средства, разбавителя для дезинфицирующих средств, источника пара и т. д.). Проблема с водой в чистых помещениях заключается в том, что она не только обеспечивает микроорганизмам возможность выживания, но и дает возможность для увеличения их количества, а микроорганизмы неизменно присутствуют во всех остатках воды (некоторые бактерии, особенно грамотрицательные, могут расти и размножаться в условиях низкого содержания питательных веществ).
Вторичными источниками загрязнения являются воздух и поверхности. Воздух в большинстве помещений содержит микроорганизмы. Количество микроорганизмов зависит от класса чистоты помещения. Воздух является вторичным источником загрязнения, поскольку он является переносчиком микроорганизмов, но не является питательной средой, и, хотя некоторые бактерии могут выживать в потоках воздуха, они не могут в нем размножаться. Как правило, в воздухе чаще всего встречаются грамположительные бактерии. Микроорганизмы в воздухе обычно находятся вместе с частицами пыли или чешуйками кожи, а не в виде отдельных микроорганизмов (для обозначения которых иногда используется термин "частица, переносящая микроорганизмы"). Это делает микроорганизмы более тяжелыми и подверженными гравитационному оседанию. Поэтому зачастую важнее всего не количество микроорганизмов в воздухе, а их способность к оседанию. Хорошо спроектированное чистое помещение будет фильтровать воздух (чтобы уменьшить количество микроорганизмов) и иметь каскад давления, чтобы предотвратить повторное загрязнение чистой зоны из менее чистой (поскольку микроорганизмы не могут двигаться против воздушного потока).
Другим вторичным источником загрязнения являются материалы и поверхности. Здесь основными рисками являются перенос предметов в чистую зону и из нее, при этом материалы подвергаются большему риску, если они имеют конструкцию, которую невозможно легко очистить или продезинфицировать; а также в случае прикосновения персонала к поверхностям. Еще один риск - загрязнение поверхностей в результате осаждения (например, оседания из воздуха).
Как минимум, программа микробиологического мониторинга производственной среды должна включать следующие элементы:
- Методы мониторинга
- Питательные среды и условия инкубации
- Периодичность мониторинга производственной среды
- Выбор точек отбора проб (где будет проводиться мониторинг)
- Схемы с указанием точек отбора проб
- Продолжительность мониторинга
- Когда и где отбираются пробы (т.е. во время или по окончании работ)
- Методические указания, описывающие порядок отбора проб, и методы, описывающие порядок обращения с пробами
- Четкие обязанности, описывающие, кто может отбирать пробы
- Обработка и инкубация образцов
- Уровни тревоги и действия
- Анализ данных, включая тренды
- Проведение расследований в случае превышения уровней действий
- Соответствующие корректирующие и предупреждающие действия в случае превышения уровня действия
- Рассмотрение необходимости проведения специальных видов мониторинга производственной среды (например, использование селективных агаров для нежелательных микроорганизмов или анаэробный мониторинг)
Методы микробиологического мониторинга:
- Активный отбор проб воздуха: аспирационный метод
- Пассивный отбор проб воздуха: седиментационный метод
- Отбор проб с поверхностей: контактные пластины и метод смывов тампоном (свабы)
- Отбор проб с персонала: пластины для пальцев и пластины для обежды
Аспирационный отбор проб воздуха
Активный пробоотборник воздуха (аспиратор) собирает определенную долю микроорганизмов, присутствующих в данном объеме воздуха. Объем отбираемого воздуха обычно составляет один кубический метр (результаты выражаются в КОЕ / м3).
В процессе эксплуатации аспираторов следует учитывать, что сами устройства могут генерировать относительно высокий уровень аэрозольных частиц, и это особенно должно учитываться при использовании в зонах класса A. К другим аспектам использования относится пригодность пробоотборника к дезинфицирующим средствам, используемым для оборудования чистых помещений.
Седиментационные пластины
Седиментационные пластины – это агаровые пластины, обычно диаметром 9 см или 14 см (чашки Петри). Они предназначены для обнаружения любых микроорганизмов, переносимых воздушным потоком, которые непосредственно оседают в определенной области. Если седиментационные пластины расположены в соответствующих местах, они могут дать представление о том, как часто и, возможно, как много микроорганизмов попало на критически важную поверхность или в любой подвергающийся воздействию продукт. Результаты, полученные с помощью седиментационных пластин, могут быть оценены как количество колоний микроорганизмов на пластину или полуколичественно путем подсчета количества микроорганизмов в единицу времени (время – это продолжительность контакта с пластиной). В таких руководствах, как EU GMP, уровни действий выражаются в КОЕ (колониеобразующих единицах) за четыре часа.
Для того чтобы определить, влияет ли потеря веса агара в пластине на ростовые свойства пластины после экспозиции, необходимо валидировать длительность использования пластины. Это можно оценить, разработав эксперимент, в котором пластины предварительно взвешиваются и выставляются на определенное время в наихудших условиях (обычно в шкафу с однонаправленным потоком воздуха (UDAF), поскольку такая среда вызывает наибольшее высыхание). После экспозиции пластины могут быть обработаны соответствующим набором тест-штаммов микроорганизмов, чтобы определить, повлияла ли степень "высыхания" на способность пластин поддерживать рост микроорганизмов.
Отбор образцов с поверхности: контактные пластины и свабы
Контактные пластины – это пластины агара, обычно диаметром 25 см2, с приподнятой (куполообразной) поверхностью, сконструированной таким образом, чтобы при переворачивании пластины агар прижимался к поверхности. Воспроизводимость контактных пластин можно повысить, установив время взятия пробы и контролируя прилагаемое давление. Для этого существуют коммерческие устройства.
Свабы обычно состоят из стерильных хлопковых (или чаще всего из синтетических) наконечников. Они либо содержатся в среде, либо требуют предварительного смачивания подходящей средой для восстановления (например, фосфатно-буферным солевым раствором или стерильной водой). Свабы либо предназначены для субкультивирования на агаре, либо растворяются и фильтруются через мембрану. Свабы удобны для отбора проб с небольших участков или изогнутых поверхностей.
Выделение микроорганизмов из контактных пластин превосходит таковое из свабов, поэтому предпочтительно использовать контактные пластины (при этом свабы могут использоваться там, где контактные пластины невозможны, например, на узких или неровных поверхностях).
Существует ряд практических соображений при отборе проб с поверхности. Важно, чтобы после использования контактных пластин или тампонов остатки (агар или растворитель) всегда протирались подходящим дезинфицирующим средством во избежании образования остаточного материала для роста микроорганизмов. Еще одним соображением является то, что при мониторинге критических видов деятельности отбор проб проводится по окончании деятельности из-за инвазивного характера отбора проб.
Мониторинг поверхностей также подразделяется на мониторинг поверхностей пола и стен и поверхностей оборудования на рабочей высоте. Поверхности оборудования на рабочей высоте обычно имеют более жесткие критерии и считаются более критичными, поскольку они являются зонами, контактирующими с продуктом. Пробы с пола/стен обычно имеют более низкие пределы, так как продукт не соприкасается с полом/стенами, и мониторинг этих мест служит проверкой методов очистки и дезинфекции.
Мониторинг персонала
Для некоторых операций, прежде всего асептических процессов, у персонала, работающего в чистых помещениях, отбираются образцы. Эти образцы представляют собой отпечатки перчаток, образцы с технологической одежды операторов (рукава часто являются зоной наибольшего риска в отношении манипуляций персонала с продуктом или оборудованием).
Пробы с перчаток отбираются с помощью пальцевых пластин, когда каждый палец руки в перчатке прижимается к поверхности агаровой пластины (размером 9 см или больше). Пробы рукавов отбираются с помощью контактных пластин. Таким образом, оба типа проб могут быть количественно определены как КОЕ на пять пальцев руки или как КОЕ на 25 см2. Кроме того, пробы перчаток и рукавов изоляторов и RABS (Rapid Access Barrier Systems) также берутся в конце кампаний (хотя эти пробы не избавляют от необходимости проверки герметичности перчаток и рукавов на месте). Пробы с рук персонала отбираются через различные промежутки времени после каждой критической операции. Для обеспечения репрезентативности результатов мониторинга руки операторов не должны быть обработаны перед отбором проб. Однако после отбора проб руки должны быть продезинфицированы с помощью дезинфицирующего средства. Пробы с технологической одежды отбираются по окончании процесса.
Выбор точек отбора проб
Порядок выбора точек отбора проб описан в первой статье «Мониторинг производственной среды».
Обязанности по отбору проб
Сотрудники, отбирающие пробы для мониторинга, должны быть четко определены в письменной процедуре. Обычно пробы отбирают обученные микробиологи в асептических зонах, однако существуют два различных подхода. Согласно одному подходу, все пробы для мониторинга производственной среды должны отбираться независимыми сотрудниками отдела контроля качества. Другой подход заключается в том, что присутствие дополнительного персонала в чистом помещении повышает риск, и чтобы избежать этого риска, мониторинг должен проводить производственный персонал. Альтернативный подход заключается в том, что производственный персонал должен отбирать большинство проб в асептической зоне, но при этом сотрудники отдела контроля качества должны периодически контролировать критический производственный процесс (например, отбирать пробы из расчета 1 к 10). Если пробы отбирает производственный персонал, важно, чтобы он проходил такую же строгую программу обучения, как и сотрудники отдела контроля качества, и был обучен основам микробиологии.
Периодичность мониторинга
Периодичность мониторинга производственной среды для стерильных продуктов (асептически наполненных или термически стерилизованных) определена в нормативном руководстве: он должен быть непрерывным в течение всего процесса наполнения и в те моменты, когда продукт или его компоненты подвергаются воздействию. Мониторинг производственной среды для других видов деятельности требует установки частоты мониторинга, основанной на оценке риска деятельности в чистом помещении. Периодичность мониторинга должна быть достаточно частой, чтобы можно было оценить значимые тенденции. К числу рисков, которые необходимо учитывать, относятся:
- Температура в помещении (в холодных помещениях риск ниже, чем в помещениях с температурой окружающей среды, поскольку низкая температура оказывает микростатическое воздействие на большинство бактерий);
- Является ли помещение обычно "влажным" (например, моечная) или сухим. Влажные помещения представляют больший риск загрязнения, поэтому их следует контролировать чаще;
- Наличие слива (при наличии слива риск может быть выше из-за обратного потока);
- История мониторинга производственной среды в чистом помещении. Помещения с плохой историей требуют более тщательной оценки;
- Очищается ли оборудование на месте или оно мобильное и очищается в другом месте (стационарное оборудование легче контролировать);
- Является ли очистка оборудования ручной или автоматизированной (автоматизированную очистку легче подтвердить и, следовательно, она более надежна);
- Открытые или закрытые системы (при открытой обработке риск наибольший);
- Продолжительность производственного процесса (чем дольше процесс, тем больше вероятность того, что что-то повлияет на продукт);
- Количество персонала в помещении (так как персонал является основным источником контаминации в чистых помещениях).
После детальной оценки этих факторов устанавливается периодичность мониторинга: помещения, в которых происходит открытая обработка или в которых работает большое количество персонала, требуют более частого мониторинга, в то время как помещения, в которых происходит автоматизированная обработка или которые используются редко, требуют более низкого уровня мониторинга. Для нестерильного производства подходящей периодичностью мониторинга являются два раза в неделю, один раз в неделю, каждые две недели и ежемесячно.
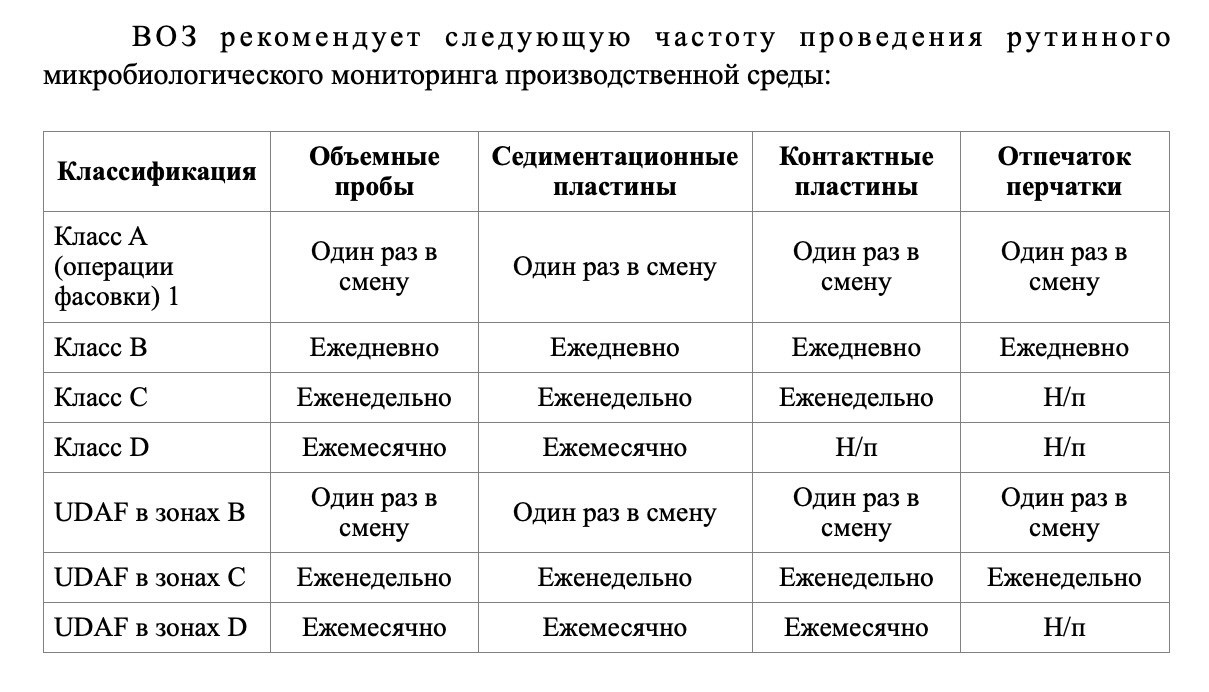
В дополнение к установленной программе могут проводиться и другие отборы проб, например, сразу после санитарной обработки, чтобы оценить эффективность очистки. Другим примером таргетного мониторинга является мониторинг после технического обслуживания и после остановки технологического участка для оценки пригодности к началу производства. Другие виды мониторинга могут проводиться реже. К ним можно отнести исследования с использованием селективных агаров (например, в сезоны, когда грибы могут вызывать опасения) или специальных условий инкубации (например, мониторинг анаэробных бактерий при использовании газопроводов с азотом).
Длительность мониторинга
При наполнении стерильных продуктов мониторинг должен проводиться в течение всего времени наполнения. Для других видов деятельности и в чистых помещениях более низкого класса продолжительность мониторинга обычно составляет от одного до четырех часов (что основано на времени экспозиции седиментационных пластин). Этого обычно достаточно, поскольку ни одна программа микробиологического мониторинга не может (или не должна) оценить все микробиологическое загрязнение в чистом помещении во время его использования. Программы разрабатываются на определенное время, и при условии, что помещения используются во время отбора проб и что частота мониторинга достаточно частая, чтобы можно было оценить тенденции изменения данных.
Питательные среды
Целью большинства программ мониторинга производственной среды является обнаружение мезофильных бактерий и грибов (организмов, которые растут при температуре от 20 до 35°C), поскольку именно эти микроорганизмы наиболее вероятны и представляют наибольший риск для большинства продуктов. Для обнаружения таких микроорганизмов обычно используется либо одна питательная среда, которая подвергается двухступенчатому режиму инкубации, либо две микробиологические питательные среды, которые инкубируются при разных температурах.
При использовании обоих режимов инкубирования предполагается извлечь как бактерии, так и грибы (при использовании двух сред одна среда предназначена для стимулирования роста бактерий, а другая – для обнаружения грибов). Если используется одна среда, то самой распространенной неселективной питательной средой является соево-казеиновый агар (триптон-соевый агар (TSA)). Если используются две среды, то для бактерий часто используется TSA, а для грибов используется селективная среда. Выбор среды зависит от типов грибов, наиболее распространенных в производственной среде. К распространенным средам относятся среда Сабуро, агар с экстрактом солода, картофельный агар с декстрозой или розовый бенгальский агар. Эти среды могут иметь измененный pH или содержать антибиотики для подавления роста бактерий.
Выбор одной среды требует проведения подтверждающих исследований с использованием грибов, выделенных из среды чистых помещений или из соседних чистых помещений.
Перед использованием все питательные среды должны быть валидированы. Валидация питательных сред обычно заключается в тестировании образцов среды при всех применимых температурах инкубации и с использованием тест-штаммов микроорганизмов. Используются микроорганизмы, рекомендованные фармакопеей (Bacillus subtilis, Staphylococcus aureus, Candida albicans, Pseudomonas aeruginosa и Aspergillus niger), а также ряд изолятов из производственной среды чистых помещений. Инокулят должен составлять менее 100 КОЕ. Надежное восстановление небольших количеств микроорганизмов является предпосылкой успешного мониторинга чистых помещений, поскольку в чистых помещениях не будет присутствовать большое количество микроорганизмов. После валидации необходимо проводить рутинное тестирование ростовых свойств для каждой партии питательной среды при репрезентативной температуре инкубации. Это необходимо, отчасти из-за вариаций при производстве сред, а отчасти из-за рисков, связанных с транспортировкой сред, когда среды могут подвергаться экстремальным температурным воздействиям.
Некоторые практические аспекты, связанные с использованием питательных сред, включают важность проведения оценки метода трансфера питательной среды в чистое помещение из соседней чистой зоны или в изолятор, чтобы убедиться, что этот метод не вызывает ингибирования роста микроорганизмов. Например, может оказаться, что перекись водорода или перуксусная кислота, используемые для санитарной обработки в изоляторе, могут вызвать ингибирование, если дезинфицирующее средство проникнет в пакеты, содержащие среды. Для борьбы с этим в среду могут быть добавлены нейтрализаторы (например, пируват для нейтрализации перекиси водорода).
Еще одно соображение заключается в том, что в тех случаях, когда возможно наличие остатков дезинфицирующих средств, среды, используемые для отбора проб с поверхностей и персонала, должны также содержать подходящий нейтрализатор дезинфицирующих средств для борьбы с остатками дезинфицирующих средств на поверхностях или остатками средств для дезинфекции рук на руках в перчатках.
Еще один вопрос заключается в том, что среды должны быть стерильными. Стерилизация питательных сред обычно осуществляется методом радиационной стерилизации ионизирующим излучением. Необходимо провести исследования, чтобы показать, что метод стерилизации не приводит к последующему ингибированию роста микроорганизмов.
Инкубация проб
Образцы, полученные в ходе мониторинга производственной среды, должны инкубироваться в течение заранее определенного времени и при определенном температурном режиме. Время инкубации можно определить, извлекая образцы через определенные промежутки времени, подсчитывая их (стараясь не вызвать случайного загрязнения) и повторно инкубируя в течение определенного периода времени, чтобы установить точку, когда рост видимых колоний больше не происходит. Что касается требований к температуре, то это зависит от того, используется ли одна или две питательные среды (как описано выше). Если используются две питательные среды, режим инкубирования обычно следующий:
Важным моментом является порядок инкубации. Аргумент в пользу первой более низкой температуры заключается в том, что грибы, скорее всего, находятся в стрессовом состоянии и их следует стимулировать к росту в первую очередь.
Аргумент в пользу более высокой температуры заключается в том, что в случае присутствия нитевидного гриба он может вырасти так, что заслонит колонии бактерий. Принятое решение должно быть обосновано и основано на данных об исследуемых пробах.
Последствия высушивания седиментационной пластины во время отбора проб или транспортировки в микробиологическую лабораторию должны определяться в рамках валидационного исследования. Следует установить временные пределы для обеспечения жизнеспособности микроорганизмов, пока они не будут помещены в условия для выявления ростовых свойств.
Интерпретация результатов осуществляется в конце последнего периода инкубации. Важно не оставлять образцы в инкубаторе на слишком долгий срок, поскольку происходит высыхание агара. Это может сделать пластину нечитаемой и привести к тому, что рост микроорганизмов невозможно будет охарактеризовать.
Анализ трендов в ходе микробиологического мониторинга
Микроорганизмы, выявленные в ходе программы мониторинга, должны быть исследованы и проанализированы. Для этой оценки все микроорганизмы из проб, взятых в ходе мониторинга в зоне класса A / ISO 5, должны быть идентифицированы до вида. Для чистых зон более низкого класса рекомендуется идентифицировать все результаты проб, которые превышают уровень действия. Наиболее важными причинами для исследования микрофлоры являются поиск нежелательных микроорганизмов, которые могут представлять риск для продукции или в связи с ненадлежащей очисткой и дезинфекцией, а также для помощи в расследовании результатов, выходящих за пределы нормы.
Длительность мониторинга
При наполнении стерильных продуктов мониторинг должен проводиться в течение всего времени наполнения. Для других видов деятельности и в чистых помещениях более низкого класса продолжительность мониторинга обычно составляет от одного до четырех часов (что основано на времени экспозиции седиментационных пластин). Этого обычно достаточно, поскольку ни одна программа микробиологического мониторинга не может (или не должна) оценить все микробиологическое загрязнение в чистом помещении во время его использования. Программы разрабатываются на определенное время, и при условии, что помещения используются во время отбора проб и что частота мониторинга достаточно частая, чтобы можно было оценить тенденции изменения данных.
Питательные среды
Целью большинства программ мониторинга производственной среды является обнаружение мезофильных бактерий и грибов (организмов, которые растут при температуре от 20 до 35°C), поскольку именно эти микроорганизмы наиболее вероятны и представляют наибольший риск для большинства продуктов. Для обнаружения таких микроорганизмов обычно используется либо одна питательная среда, которая подвергается двухступенчатому режиму инкубации, либо две микробиологические питательные среды, которые инкубируются при разных температурах.
При использовании обоих режимов инкубирования предполагается извлечь как бактерии, так и грибы (при использовании двух сред одна среда предназначена для стимулирования роста бактерий, а другая – для обнаружения грибов). Если используется одна среда, то самой распространенной неселективной питательной средой является соево-казеиновый агар (триптон-соевый агар (TSA)). Если используются две среды, то для бактерий часто используется TSA, а для грибов используется селективная среда. Выбор среды зависит от типов грибов, наиболее распространенных в производственной среде. К распространенным средам относятся среда Сабуро, агар с экстрактом солода, картофельный агар с декстрозой или розовый бенгальский агар. Эти среды могут иметь измененный pH или содержать антибиотики для подавления роста бактерий.
Выбор одной среды требует проведения подтверждающих исследований с использованием грибов, выделенных из среды чистых помещений или из соседних чистых помещений.
Перед использованием все питательные среды должны быть валидированы. Валидация питательных сред обычно заключается в тестировании образцов среды при всех применимых температурах инкубации и с использованием тест-штаммов микроорганизмов. Используются микроорганизмы, рекомендованные фармакопеей (Bacillus subtilis, Staphylococcus aureus, Candida albicans, Pseudomonas aeruginosa и Aspergillus niger), а также ряд изолятов из производственной среды чистых помещений. Инокулят должен составлять менее 100 КОЕ. Надежное восстановление небольших количеств микроорганизмов является предпосылкой успешного мониторинга чистых помещений, поскольку в чистых помещениях не будет присутствовать большое количество микроорганизмов. После валидации необходимо проводить рутинное тестирование ростовых свойств для каждой партии питательной среды при репрезентативной температуре инкубации. Это необходимо, отчасти из-за вариаций при производстве сред, а отчасти из-за рисков, связанных с транспортировкой сред, когда среды могут подвергаться экстремальным температурным воздействиям.
Некоторые практические аспекты, связанные с использованием питательных сред, включают важность проведения оценки метода трансфера питательной среды в чистое помещение из соседней чистой зоны или в изолятор, чтобы убедиться, что этот метод не вызывает ингибирования роста микроорганизмов. Например, может оказаться, что перекись водорода или перуксусная кислота, используемые для санитарной обработки в изоляторе, могут вызвать ингибирование, если дезинфицирующее средство проникнет в пакеты, содержащие среды. Для борьбы с этим в среду могут быть добавлены нейтрализаторы (например, пируват для нейтрализации перекиси водорода).
Еще одно соображение заключается в том, что в тех случаях, когда возможно наличие остатков дезинфицирующих средств, среды, используемые для отбора проб с поверхностей и персонала, должны также содержать подходящий нейтрализатор дезинфицирующих средств для борьбы с остатками дезинфицирующих средств на поверхностях или остатками средств для дезинфекции рук на руках в перчатках.
Еще один вопрос заключается в том, что среды должны быть стерильными. Стерилизация питательных сред обычно осуществляется методом радиационной стерилизации ионизирующим излучением. Необходимо провести исследования, чтобы показать, что метод стерилизации не приводит к последующему ингибированию роста микроорганизмов.
Инкубация проб
Образцы, полученные в ходе мониторинга производственной среды, должны инкубироваться в течение заранее определенного времени и при определенном температурном режиме. Время инкубации можно определить, извлекая образцы через определенные промежутки времени, подсчитывая их (стараясь не вызвать случайного загрязнения) и повторно инкубируя в течение определенного периода времени, чтобы установить точку, когда рост видимых колоний больше не происходит. Что касается требований к температуре, то это зависит от того, используется ли одна или две питательные среды (как описано выше). Если используются две питательные среды, режим инкубирования обычно следующий:
- для бактерий: 30-35°C
- для грибов: 20-25°C.
Важным моментом является порядок инкубации. Аргумент в пользу первой более низкой температуры заключается в том, что грибы, скорее всего, находятся в стрессовом состоянии и их следует стимулировать к росту в первую очередь.
Аргумент в пользу более высокой температуры заключается в том, что в случае присутствия нитевидного гриба он может вырасти так, что заслонит колонии бактерий. Принятое решение должно быть обосновано и основано на данных об исследуемых пробах.
Последствия высушивания седиментационной пластины во время отбора проб или транспортировки в микробиологическую лабораторию должны определяться в рамках валидационного исследования. Следует установить временные пределы для обеспечения жизнеспособности микроорганизмов, пока они не будут помещены в условия для выявления ростовых свойств.
Интерпретация результатов осуществляется в конце последнего периода инкубации. Важно не оставлять образцы в инкубаторе на слишком долгий срок, поскольку происходит высыхание агара. Это может сделать пластину нечитаемой и привести к тому, что рост микроорганизмов невозможно будет охарактеризовать.
Анализ трендов в ходе микробиологического мониторинга
Микроорганизмы, выявленные в ходе программы мониторинга, должны быть исследованы и проанализированы. Для этой оценки все микроорганизмы из проб, взятых в ходе мониторинга в зоне класса A / ISO 5, должны быть идентифицированы до вида. Для чистых зон более низкого класса рекомендуется идентифицировать все результаты проб, которые превышают уровень действия. Наиболее важными причинами для исследования микрофлоры являются поиск нежелательных микроорганизмов, которые могут представлять риск для продукции или в связи с ненадлежащей очисткой и дезинфекцией, а также для помощи в расследовании результатов, выходящих за пределы нормы.
