Критерии приемлемости для валидации очистки состоят из нескольких элементов:
- Соблюдение безопасных пределов остаточного загрязнения
- Соответствие критериям визуальной чистоты
- Демонстрация воспроизводимого и последовательного процесса очистки
- Контроль уровня бионагрузки и эндотоксинов
Пределы остаточного загрязнения при очистке мультипродуктового оборудования (на совмещенном производстве)
Оборудование должно быть очищено до такого уровня, чтобы любые остатки (API, промежуточные продукты процесса, вспомогательные вещества, примеси, побочные продукты, продукты деградации, накопленный продукт и моющие средства) от предыдущей обработки не влияли на безопасность, идентичность, качество и чистоту следующего произведенного продукта. Учитывая это, при определении уровня требуемой чистоты поверхностей оборудования, непосредственно контактирующих с продуктом, есть два важных аспекта:
Пороговое значение представляет собой допустимый предел очистки, соответствующий безопасному количеству остаточного загрязнения в следующей дозе продукта или партии.
В целях идентификации возникающих рисков следует использовать допустимые пределы воздействия на здоровье (Health Based Exposure Limits (HBEL)) для содержания контаминирующего вещества. Применяемые производителем инструменты подхода к идентификации рисков должны быть основаны на использовании научной оценки фармакологических и токсикологических данных для критериев оценки: допустимой ежедневной экспозиции (Permitted Daily Exposure (PDE)), пороге токсикологической угрозы (Threshold of Toxicological Concern (TTC)), приемлемой ежедневной экспозиции (Acceptable Daily Exposure (ADE))
Оборудование должно быть очищено до такого уровня, чтобы любые остатки (API, промежуточные продукты процесса, вспомогательные вещества, примеси, побочные продукты, продукты деградации, накопленный продукт и моющие средства) от предыдущей обработки не влияли на безопасность, идентичность, качество и чистоту следующего произведенного продукта. Учитывая это, при определении уровня требуемой чистоты поверхностей оборудования, непосредственно контактирующих с продуктом, есть два важных аспекта:
- Оборудование должно быть визуально чистым
- Оборудование должно быть очищено до уровня ниже безопасного порогового значения
Пороговое значение представляет собой допустимый предел очистки, соответствующий безопасному количеству остаточного загрязнения в следующей дозе продукта или партии.
В целях идентификации возникающих рисков следует использовать допустимые пределы воздействия на здоровье (Health Based Exposure Limits (HBEL)) для содержания контаминирующего вещества. Применяемые производителем инструменты подхода к идентификации рисков должны быть основаны на использовании научной оценки фармакологических и токсикологических данных для критериев оценки: допустимой ежедневной экспозиции (Permitted Daily Exposure (PDE)), пороге токсикологической угрозы (Threshold of Toxicological Concern (TTC)), приемлемой ежедневной экспозиции (Acceptable Daily Exposure (ADE))
Acceptable Daily Exposure (ADE) и Permitted Daily Exposure (PDE)
Допустимые пределы остаточного загрязнения при очистке должны быть основаны на токсикологических оценках с использованием HBEL (т.е. ADE или PDE) в качестве базового уровня. ADE представляет собой дозу, которая с незначительной долей вероятности вызовет неблагоприятный эффект, если индивид ежедневно в течение всей жизни подвергается воздействию в дозе, равной ей или ниже. ADE и PDE фактически являются синонимами в соответствии с рекомендациями EMA и PICs. Соответственно, предел очистки, основанный на значении ADE или PDE, используется в качестве критерия безопасного предельного остатка для валидации очистки.
Определение значений PDE предполагает привлечение квалифицированных экспертов в соответствующих областях (например, токсикологии, фармакологии) и требует оценки опасностей, критических эффектов, уровней ненаблюдаемых неблагоприятных эффектов (NOAEL) для результатов, считающихся критическими эффектами, и использования соответствующих поправочных коэффициентов. При выведении значений PDE также учитывается предполагаемый клинический путь введения и соответствующая биодоступность. Примеры расчетов PDE приведены в Руководстве по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях, утвержденным Решением Коллегии Евразийской экономической комиссии от 14 января 2020 г. N 1.
Использование других подходов для определения HBEL может считаться приемлемым для регулирующих органов, если это будет адекватно и научно обосновано.
Допустимые пределы остаточного загрязнения при очистке должны быть основаны на токсикологических оценках с использованием HBEL (т.е. ADE или PDE) в качестве базового уровня. ADE представляет собой дозу, которая с незначительной долей вероятности вызовет неблагоприятный эффект, если индивид ежедневно в течение всей жизни подвергается воздействию в дозе, равной ей или ниже. ADE и PDE фактически являются синонимами в соответствии с рекомендациями EMA и PICs. Соответственно, предел очистки, основанный на значении ADE или PDE, используется в качестве критерия безопасного предельного остатка для валидации очистки.
Определение значений PDE предполагает привлечение квалифицированных экспертов в соответствующих областях (например, токсикологии, фармакологии) и требует оценки опасностей, критических эффектов, уровней ненаблюдаемых неблагоприятных эффектов (NOAEL) для результатов, считающихся критическими эффектами, и использования соответствующих поправочных коэффициентов. При выведении значений PDE также учитывается предполагаемый клинический путь введения и соответствующая биодоступность. Примеры расчетов PDE приведены в Руководстве по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях, утвержденным Решением Коллегии Евразийской экономической комиссии от 14 января 2020 г. N 1.
Использование других подходов для определения HBEL может считаться приемлемым для регулирующих органов, если это будет адекватно и научно обосновано.
Порог токсикологической угрозы (Threshold of Toxicological Concern (TTC))
Порог токсикологической угрозы может рассматриваться как предшественник HBEL, обычно принимаются регулирующими органами для определения MACO, когда имеются только предварительные токсикологические данные, для таких групп, как, например, исследуемые лекарственные препараты, детергенты или генотоксические активные вещества, для которых не установлен порог. По мере получения достаточных токсикологических данных для установления ADE или PDE следует провести оценку для пересчета порогового значения с использованием ADE или PDE.
Порог токсикологической угрозы может рассматриваться как предшественник HBEL, обычно принимаются регулирующими органами для определения MACO, когда имеются только предварительные токсикологические данные, для таких групп, как, например, исследуемые лекарственные препараты, детергенты или генотоксические активные вещества, для которых не установлен порог. По мере получения достаточных токсикологических данных для установления ADE или PDE следует провести оценку для пересчета порогового значения с использованием ADE или PDE.
Терапевтическая доза
Терапевтическая доза – это ранее используемый подход, который использовался до смены парадигмы для обоснования пределов очистки с использованием HBEL. Значения рассчитываются путем деления минимальной суточной терапевтической дозы на коэффициент безопасности (т. е. обычно 1000, но может варьироваться в зависимости от способа введения). Концепция заключается в том, что доля (например, 1/1000) минимальной суточной терапевтической дозы не окажет терапевтического эффекта на человека и тем самым обеспечит безопасность пациента.
Терапевтическая доза напрямую связана не с безопасностью лекарственного средства, а с его эффективностью. Она не учитывает побочные эффекты и длительность воздействия (т. е. от однократного воздействия до воздействия в течение всей жизни). Для обеспечения безопасности пациента применяются большие коэффициенты безопасности. В результате пределы, основанные на терапевтической дозе, обычно ниже по сравнению с пределами, основанными на ADE и PDE.
Для производителей, использующих пределы, основанные на подходе терапевтической дозы (в основном, данный подход применим к существующим продуктам), необходимо определить пороговое значение с помощью ADE или PDE. Предприятиям необходимо определить, представляют ли остатки при очистке риск возникновения неблагоприятных последствий для здоровья людей, подвергшихся воздействию. Если используемый предел, основанный на терапевтической дозе, ниже предела, рассчитанного с использованием значений ADE или PDE, данный предел может быть использован в качестве уровня предупреждения в программе очистки. Если предел, рассчитанный на основе ADE/PDE, ниже, чем существующий предел, основанный на терапевтической дозе, то вводится новое пороговое значение, основанное на ADE/PDE.
Терапевтическая доза – это ранее используемый подход, который использовался до смены парадигмы для обоснования пределов очистки с использованием HBEL. Значения рассчитываются путем деления минимальной суточной терапевтической дозы на коэффициент безопасности (т. е. обычно 1000, но может варьироваться в зависимости от способа введения). Концепция заключается в том, что доля (например, 1/1000) минимальной суточной терапевтической дозы не окажет терапевтического эффекта на человека и тем самым обеспечит безопасность пациента.
Терапевтическая доза напрямую связана не с безопасностью лекарственного средства, а с его эффективностью. Она не учитывает побочные эффекты и длительность воздействия (т. е. от однократного воздействия до воздействия в течение всей жизни). Для обеспечения безопасности пациента применяются большие коэффициенты безопасности. В результате пределы, основанные на терапевтической дозе, обычно ниже по сравнению с пределами, основанными на ADE и PDE.
Для производителей, использующих пределы, основанные на подходе терапевтической дозы (в основном, данный подход применим к существующим продуктам), необходимо определить пороговое значение с помощью ADE или PDE. Предприятиям необходимо определить, представляют ли остатки при очистке риск возникновения неблагоприятных последствий для здоровья людей, подвергшихся воздействию. Если используемый предел, основанный на терапевтической дозе, ниже предела, рассчитанного с использованием значений ADE или PDE, данный предел может быть использован в качестве уровня предупреждения в программе очистки. Если предел, рассчитанный на основе ADE/PDE, ниже, чем существующий предел, основанный на терапевтической дозе, то вводится новое пороговое значение, основанное на ADE/PDE.
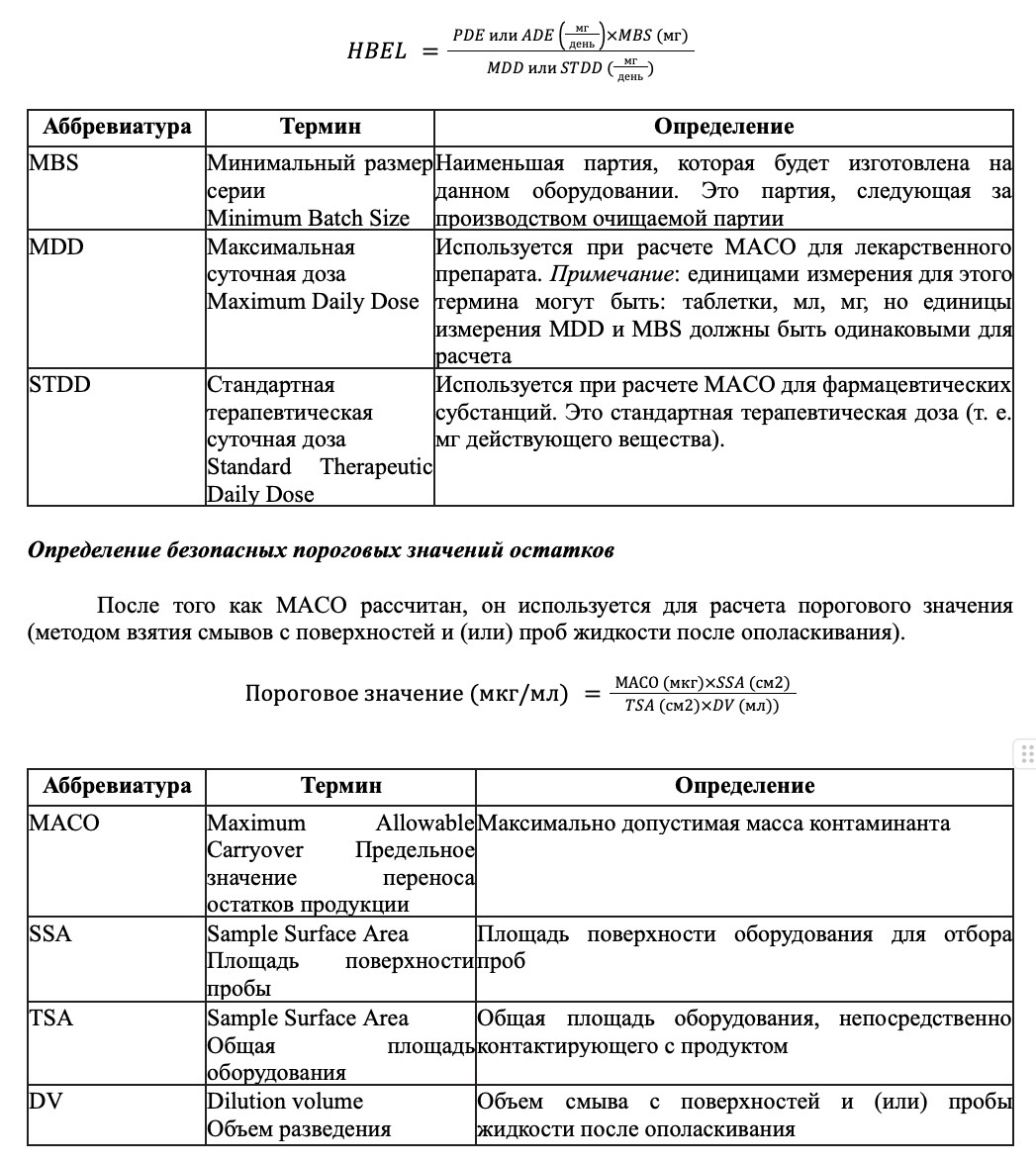
Расчет МАСО
Основным способом расчета порогового значения является определение предельного значения переноса остатков продукции (Maximum Allowable Carryover (MACO)).
MACO выражается либо как концентрация остаточного загрязнения, либо как масса остаточного загрязнения, допустимая в следующей изготовленной партии с точки зрения безопасности пациента. При выражении в виде концентрации для определения количества переноса необходимо умножить ее на наименьший размер следующей партии продукта.
Основным способом расчета порогового значения является определение предельного значения переноса остатков продукции (Maximum Allowable Carryover (MACO)).
MACO выражается либо как концентрация остаточного загрязнения, либо как масса остаточного загрязнения, допустимая в следующей изготовленной партии с точки зрения безопасности пациента. При выражении в виде концентрации для определения количества переноса необходимо умножить ее на наименьший размер следующей партии продукта.
Критерии приемлемости для выделенного оборудования
Критерии приемлемости для выделенного оборудования соответствуют тем же принципам, которые описаны в Руководстве для мультипродуктового оборудования. Риск перекрестного загрязнения между различными продуктами отсутствует, однако все равно необходимо удалять моющие средства, если они используются, продукты деградации, если они присутствуют, и другие остатки, исходя из понимания процесса.
Визуальный контроль чистоты и его критерии
Визуальная чистота – один из критериев, используемых для оценки чистоты поверхности. Этот критерий важен тем, что если на поверхности есть видимые остаточные загрязнения, то оборудование не считается чистым. Визуальный осмотр представляет собой активное наблюдение за всеми визуально доступными поверхностями, контактирующими с продуктом, на производственном оборудовании после каждой очистки.
Исследования видимого предела остаточного загрязнения
Можно провести исследования видимого предела остаточного загрязнения, чтобы определить уровень видимого обнаружения остатков для многих поверхностей. Метод определения уровня обнаружения заключается в нанесении уменьшающегося количества каждого остатка на тестовые купоны, представляющие поверхности оборудования, давая им высохнуть, а затем предоставляя их для просмотра группе контролеров. Несколько контролеров должны просматривать остатки при разном освещении, с разного расстояния и под разными углами, чтобы имитировать реальные условия визуального контроля, чтобы обеспечить более надежный визуальный предел.
Наименьшее количество остатков, которое видно всем наблюдателям, является пределом визуального обнаружения для данного продукта.
Для того чтобы визуальный контроль имел ценность, должна быть существенная разница между пороговым значением и уровнем остатка, оцениваемым визуально, что позволит компенсировать вариабельность между операторами, выполняющими визуальный контроль, а также вариабельность, присущую самому методу. Операторы, выполняющие визуальный контроль, должны быть квалифицированными специалистами по данному методу. Визуальный контроль должен выполняться оператором и проверяться вторым оператором до выпуска оборудования в эксплуатацию. Кроме того, после квалификации процесса очистки необходимо проводить периодический обзор средств контроля, чтобы убедиться, что на эффективность не повлияло увеличение или появление новых источников вариабельности, и подтвердить, что визуальный контроль по-прежнему является правильным и обоснованным подходом. Периодический обзор должен включать смывы с поверхностей оборудования и/или контроль проб жидкости после ополаскивания.
Бионагрузка и эндотоксины
Контроль бионагрузки и эндотоксинов предотвращает распространение микробной нагрузки и предельных концентраций эндотоксинов на поверхностях, контактирующих с продуктами технологического оборудования. Измерение предельных уровней бионагрузки необходимо для установления CHT, а в некоторых случаях предельные уровни бионагрузки и эндотоксинов устанавливаются в качестве критерия для валидации очистки. Приемлемые уровни бионагрузки и эндотоксинов определяются с помощью оценки риска. Оценка риска должна определить, необходим ли регулярный мониторинг бионагрузки и эндотоксина после валидации.
Расчет микробиологических критериев приемлемости
На сегодняшний день не существует нормативных требований по предельному количеству микроорганизмов для валидации очистки нестерильных или стерильных продуктов. Нормативные требования к производству продукции предполагают контроль бионагрузки. Однако существует множество различных методов, которые можно применить для установления пределов бионагрузки и эндотоксинов.
Расчеты пределов бионагрузки для нестерильных лекарственных средств
Согласно действующему USP <1111> Microbiological Attributes of Nonsterile Pharmaceutical Products, значимость микроорганизмов в нестерильных лекарственных средствах должна оцениваться с точки зрения использования продукта, характера продукта и потенциальной опасности для пациента. Для нестерильных продуктов отбор проб на эндотоксины с поверхностей, контактирующих с продуктом, не является необходимым.
При разработке критериев приемлемости предельных значений бионагрузки после очистки важно учитывать окружающую среду, воздействию которой подвергаются контактные поверхности оборудования. Микробиологическое качество воздуха, классифицируемого в данной зоне, должно учитываться при определении пределов бионагрузки для контактирующих поверхностей оборудования.
Например, если продукт производится в чистом помещении класса D, то следует учитывать эти пределы бионагрузки. Однако поверхности, контактирующие с продуктом, никогда не должны превышать пределы бионагрузки для зоны, в которой находится оборудование.
Ниже приведены некоторые промышленные методы расчета бионагрузки для нестерильных поверхностей. Обычно в промышленности используется метод 25 или 50 КОЕ на 25 см2; однако данные критерии не основаны на научном подходе. Формула, используемая ниже, может считаться более научной по сравнению с произвольными значениями. Несмотря на то, что 25 или 50 КОЕ на 25 см2 основаны на произвольных значениях, они позволяют в определенной степени контролировать бионагрузку. Приведенная ниже расчетная формула также может быть использована в качестве обоснования выпуска продукции в случае несоответствия требованиям, поскольку с точки зрения рисков она демонстрирует безопасность пациента и продукции.
Расчет и пределы для нестерильных жидких препаратов для приема внутрь
Предельное количество микроорганизмов для пероральной жидкой лекарственной формы: Общее количество аэробных микроорганизмов не более 100 КОЕ/мл
Общее количество дрожжевых и плесневых грибов не более 10 КОЕ/г
Отсутствие индикаторных организмов USP, т.е. E. coli, S. aureus и Salmonella spp.
Подход: Предельное количество КОЕ на 25 см2 можно определить, зная площадь внутренней поверхности оборудования, количество жидкости и предельное количество микроорганизмов для продукта (жидкой лекарственной формы для приема внутрь).
Пример: Оборудование имеет площадь внутренней поверхности 50 850 см² и вместимость 500 л для жидкой лекарственной формы для приема внутрь.
Формула:
Площадь внутренней поверхности = 50 850 см². Объем партии = 500 л или 500 000 мл Площадь поверхности сваба = 25 см2
Предел (ОФС): аэробные микроорганизмы не более 100 КОЕ/мл
Предел (ОФС): дрожжевые и плесневые грибы не более 10 КОЕ/мл
Коэффициент безопасности 0,01 для нестерильного продукта (коэффициент риска, применяемый для технологического оборудования, которое не стерилизуется после очистки)
Учитывая, что объем партии составляет 500 000 мл и в ней может быть не более 100 КОЕ/мл, общее количество КОЕ равно: 500 000 мл × 100 КОЕ/мл = 50 000 000 КОЕ.
Количество КОЕ на см2 равно общему количеству КОЕ, деленному на количество см2:
50 000 000 КОЕ ÷ 50 850 см2 = 983,3 КОЕ/см2.
Умножаем на коэффициент безопасности 0,01:
0,01 × 983,3 КОЕ/см2 = 9,833 КОЕ/см2.
Если размер образца составляет 25 см2:
9,833 КОЕ/см2 × 25 = 245,8 КОЕ/25 см2.
Критерий приемлемости на основе КОЕ/25 см2 площади образца составляет:
245,8 КОЕ/25 см2 (аэробные микроорганизмы) или 24,6 КОЕ/25 см2 (дрожжевые и плесневые грибы).
Расчеты пределов бионагрузки для стерильных продуктов
Для биологических или биотехнологических продуктов необходимо учитывать два набора пределов. Пределы бионагрузки для upstream процессов обычно менее строгие, чем для downstream процессов. Чем ближе к конечному продукту, тем более строгими становятся пределы. Большинство компаний используют исторические данные для определения бионагрузки в процессе разработки, а если исторических данных нет, то первоначально используется спецификация воды для инъекций (10 КОЕ/100 мл), пока не будут установлены пределы.
Для стерильных продуктов большинство пределов бионагрузки для окончательного ополаскивания после очистки основаны либо на спецификации воды очищенной (ВО) (100 КОЕ/мл), либо воды для инъекций (ВДИ) (10 КОЕ/100 мл). Этот подход можно применить для установления критериев для эндотоксинов.
Не существует нормативных требований по предельным значениям бионагрузки или эндотоксинов для предварительной очистки. Однако ожидается, что в процессе очистки будет наблюдаться снижение уровня бионагрузки как минимум на 2-3 логарифма.
Опасения, связанные с высоким уровнем бионагрузки после очистки, заключаются в том, что, если оборудование остается грязным в течение длительного периода времени, уровень бионагрузки может возрасти до такой степени, что очистка поверхностей станет затруднительной. Поэтому рекомендуется использовать коэффициент безопасности для уровней бионагрузки после очистки, который должен быть минимум на 2-3 логарифма ниже, чем при валидированном цикле стерилизации.
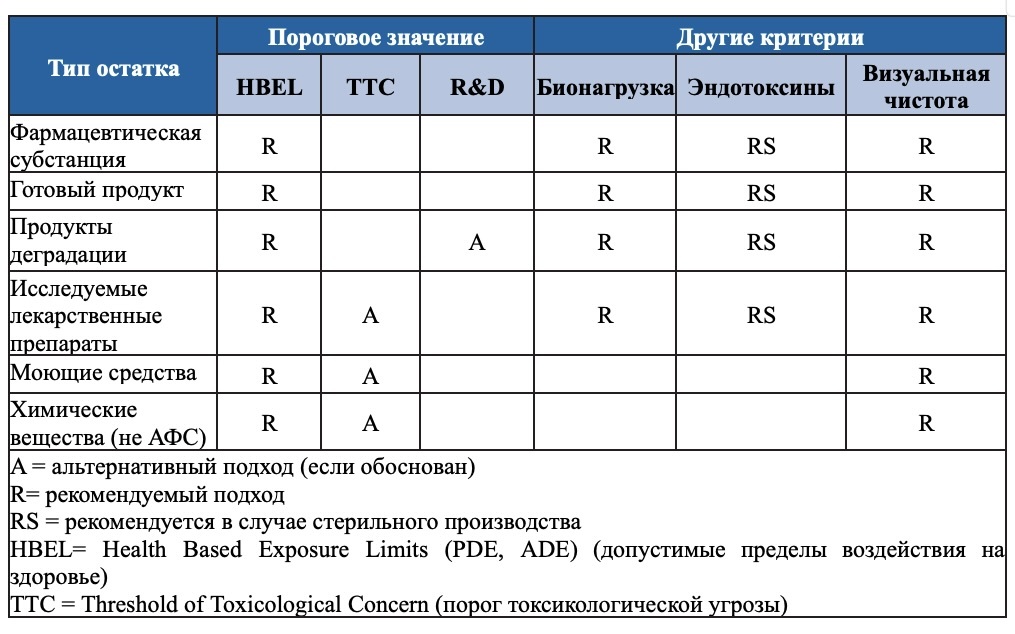
Суммируя всю информацию, в таблице ниже приведены рекомендуемые подходы к критериям в зависимости от типа активных ингредиентов или химических веществ, подлежащих очистке, и типа технологии, используемой в производстве (например, стерильное производство). Как отмечалось, использование альтернативных критериев или подходов может быть признано регулирующими органами приемлемым, если это научно обосновано и согласовано обеими сторонами.
Критерии приемлемости для выделенного оборудования соответствуют тем же принципам, которые описаны в Руководстве для мультипродуктового оборудования. Риск перекрестного загрязнения между различными продуктами отсутствует, однако все равно необходимо удалять моющие средства, если они используются, продукты деградации, если они присутствуют, и другие остатки, исходя из понимания процесса.
Визуальный контроль чистоты и его критерии
Визуальная чистота – один из критериев, используемых для оценки чистоты поверхности. Этот критерий важен тем, что если на поверхности есть видимые остаточные загрязнения, то оборудование не считается чистым. Визуальный осмотр представляет собой активное наблюдение за всеми визуально доступными поверхностями, контактирующими с продуктом, на производственном оборудовании после каждой очистки.
Исследования видимого предела остаточного загрязнения
Можно провести исследования видимого предела остаточного загрязнения, чтобы определить уровень видимого обнаружения остатков для многих поверхностей. Метод определения уровня обнаружения заключается в нанесении уменьшающегося количества каждого остатка на тестовые купоны, представляющие поверхности оборудования, давая им высохнуть, а затем предоставляя их для просмотра группе контролеров. Несколько контролеров должны просматривать остатки при разном освещении, с разного расстояния и под разными углами, чтобы имитировать реальные условия визуального контроля, чтобы обеспечить более надежный визуальный предел.
Наименьшее количество остатков, которое видно всем наблюдателям, является пределом визуального обнаружения для данного продукта.
Для того чтобы визуальный контроль имел ценность, должна быть существенная разница между пороговым значением и уровнем остатка, оцениваемым визуально, что позволит компенсировать вариабельность между операторами, выполняющими визуальный контроль, а также вариабельность, присущую самому методу. Операторы, выполняющие визуальный контроль, должны быть квалифицированными специалистами по данному методу. Визуальный контроль должен выполняться оператором и проверяться вторым оператором до выпуска оборудования в эксплуатацию. Кроме того, после квалификации процесса очистки необходимо проводить периодический обзор средств контроля, чтобы убедиться, что на эффективность не повлияло увеличение или появление новых источников вариабельности, и подтвердить, что визуальный контроль по-прежнему является правильным и обоснованным подходом. Периодический обзор должен включать смывы с поверхностей оборудования и/или контроль проб жидкости после ополаскивания.
Бионагрузка и эндотоксины
Контроль бионагрузки и эндотоксинов предотвращает распространение микробной нагрузки и предельных концентраций эндотоксинов на поверхностях, контактирующих с продуктами технологического оборудования. Измерение предельных уровней бионагрузки необходимо для установления CHT, а в некоторых случаях предельные уровни бионагрузки и эндотоксинов устанавливаются в качестве критерия для валидации очистки. Приемлемые уровни бионагрузки и эндотоксинов определяются с помощью оценки риска. Оценка риска должна определить, необходим ли регулярный мониторинг бионагрузки и эндотоксина после валидации.
Расчет микробиологических критериев приемлемости
На сегодняшний день не существует нормативных требований по предельному количеству микроорганизмов для валидации очистки нестерильных или стерильных продуктов. Нормативные требования к производству продукции предполагают контроль бионагрузки. Однако существует множество различных методов, которые можно применить для установления пределов бионагрузки и эндотоксинов.
Расчеты пределов бионагрузки для нестерильных лекарственных средств
Согласно действующему USP <1111> Microbiological Attributes of Nonsterile Pharmaceutical Products, значимость микроорганизмов в нестерильных лекарственных средствах должна оцениваться с точки зрения использования продукта, характера продукта и потенциальной опасности для пациента. Для нестерильных продуктов отбор проб на эндотоксины с поверхностей, контактирующих с продуктом, не является необходимым.
При разработке критериев приемлемости предельных значений бионагрузки после очистки важно учитывать окружающую среду, воздействию которой подвергаются контактные поверхности оборудования. Микробиологическое качество воздуха, классифицируемого в данной зоне, должно учитываться при определении пределов бионагрузки для контактирующих поверхностей оборудования.
Например, если продукт производится в чистом помещении класса D, то следует учитывать эти пределы бионагрузки. Однако поверхности, контактирующие с продуктом, никогда не должны превышать пределы бионагрузки для зоны, в которой находится оборудование.
Ниже приведены некоторые промышленные методы расчета бионагрузки для нестерильных поверхностей. Обычно в промышленности используется метод 25 или 50 КОЕ на 25 см2; однако данные критерии не основаны на научном подходе. Формула, используемая ниже, может считаться более научной по сравнению с произвольными значениями. Несмотря на то, что 25 или 50 КОЕ на 25 см2 основаны на произвольных значениях, они позволяют в определенной степени контролировать бионагрузку. Приведенная ниже расчетная формула также может быть использована в качестве обоснования выпуска продукции в случае несоответствия требованиям, поскольку с точки зрения рисков она демонстрирует безопасность пациента и продукции.
Расчет и пределы для нестерильных жидких препаратов для приема внутрь
Предельное количество микроорганизмов для пероральной жидкой лекарственной формы: Общее количество аэробных микроорганизмов не более 100 КОЕ/мл
Общее количество дрожжевых и плесневых грибов не более 10 КОЕ/г
Отсутствие индикаторных организмов USP, т.е. E. coli, S. aureus и Salmonella spp.
Подход: Предельное количество КОЕ на 25 см2 можно определить, зная площадь внутренней поверхности оборудования, количество жидкости и предельное количество микроорганизмов для продукта (жидкой лекарственной формы для приема внутрь).
Пример: Оборудование имеет площадь внутренней поверхности 50 850 см² и вместимость 500 л для жидкой лекарственной формы для приема внутрь.
Формула:
Площадь внутренней поверхности = 50 850 см². Объем партии = 500 л или 500 000 мл Площадь поверхности сваба = 25 см2
Предел (ОФС): аэробные микроорганизмы не более 100 КОЕ/мл
Предел (ОФС): дрожжевые и плесневые грибы не более 10 КОЕ/мл
Коэффициент безопасности 0,01 для нестерильного продукта (коэффициент риска, применяемый для технологического оборудования, которое не стерилизуется после очистки)
Учитывая, что объем партии составляет 500 000 мл и в ней может быть не более 100 КОЕ/мл, общее количество КОЕ равно: 500 000 мл × 100 КОЕ/мл = 50 000 000 КОЕ.
Количество КОЕ на см2 равно общему количеству КОЕ, деленному на количество см2:
50 000 000 КОЕ ÷ 50 850 см2 = 983,3 КОЕ/см2.
Умножаем на коэффициент безопасности 0,01:
0,01 × 983,3 КОЕ/см2 = 9,833 КОЕ/см2.
Если размер образца составляет 25 см2:
9,833 КОЕ/см2 × 25 = 245,8 КОЕ/25 см2.
Критерий приемлемости на основе КОЕ/25 см2 площади образца составляет:
245,8 КОЕ/25 см2 (аэробные микроорганизмы) или 24,6 КОЕ/25 см2 (дрожжевые и плесневые грибы).
Расчеты пределов бионагрузки для стерильных продуктов
Для биологических или биотехнологических продуктов необходимо учитывать два набора пределов. Пределы бионагрузки для upstream процессов обычно менее строгие, чем для downstream процессов. Чем ближе к конечному продукту, тем более строгими становятся пределы. Большинство компаний используют исторические данные для определения бионагрузки в процессе разработки, а если исторических данных нет, то первоначально используется спецификация воды для инъекций (10 КОЕ/100 мл), пока не будут установлены пределы.
Для стерильных продуктов большинство пределов бионагрузки для окончательного ополаскивания после очистки основаны либо на спецификации воды очищенной (ВО) (100 КОЕ/мл), либо воды для инъекций (ВДИ) (10 КОЕ/100 мл). Этот подход можно применить для установления критериев для эндотоксинов.
Не существует нормативных требований по предельным значениям бионагрузки или эндотоксинов для предварительной очистки. Однако ожидается, что в процессе очистки будет наблюдаться снижение уровня бионагрузки как минимум на 2-3 логарифма.
Опасения, связанные с высоким уровнем бионагрузки после очистки, заключаются в том, что, если оборудование остается грязным в течение длительного периода времени, уровень бионагрузки может возрасти до такой степени, что очистка поверхностей станет затруднительной. Поэтому рекомендуется использовать коэффициент безопасности для уровней бионагрузки после очистки, который должен быть минимум на 2-3 логарифма ниже, чем при валидированном цикле стерилизации.
Суммируя всю информацию, в таблице ниже приведены рекомендуемые подходы к критериям в зависимости от типа активных ингредиентов или химических веществ, подлежащих очистке, и типа технологии, используемой в производстве (например, стерильное производство). Как отмечалось, использование альтернативных критериев или подходов может быть признано регулирующими органами приемлемым, если это научно обосновано и согласовано обеими сторонами.